原発性ネフローゼモデルマウスの解析
概要
ICR-derived glomerulonephritis mouse (ICGN mouse)は 生後2日齢から糸球体基底膜の肥厚および糸球体上皮細胞足突起の消失が認められ、 生後2週齢になるとすべての糸球体に傷害が認められるようになります。 その結果、濾過機構が破綻し、生後間もなく重度のアルブミン尿が認められ、 さらに病態の進行にともない低タンパク血症、高脂血症、末期症状としては腎性貧血、全身性浮腫となります。 最近になってtensin2が原因遺伝子であることがわかりました。
原因遺伝子tensin2について
ICGNマウスにおいて、tensin2のnt1477-1484(exon18)の8塩基の欠失が見つかりました。 この欠失によって、フレームシフトが起こり、nt1538にストップコドンが入ります。 そのためtensin2が正常に産生されなくなります(ref.1)。 Tensin2は、細胞接着に関わる分子ですが、腎における機能はまだわかっていません(ref.2)。 私たちの解析から、糸球体上皮細胞および尿細管に発現していることがわかりました(ref.1、写真参照)。 現在、tensin2と結合する分子を探索しています。
| ICGN | ICR |
|---|---|
|
|
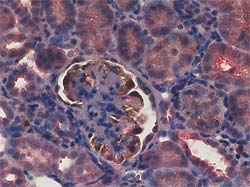
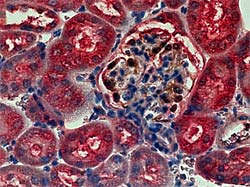
写真の説明
赤色に発色しているのが、tensin2の局在です。 茶褐色に発色しているのが、糸球体上皮細胞マーカーWT-1の局在です。
Tensin2欠損マウスの開発
Tensin2がICGNマウスネフローゼ発症の原因かどうか調べるため、Tensin2の欠失を持つコンジェニック系統(C57BL/6、DBA/2、FVB、129、BALBを遺伝的背景)を作製しました(Ref 8, 9)。その結果、DBA/2、FVB背景の系統は生後すぐ糸球体基底膜の肥厚、糸球体上皮細胞足突起の消失が認められ(写真参照)、ネフローゼを発症しましたが、その他系統については腎病変が全く確認されませんでした。さらにFVB背景の系統は、ICGNマウスより重篤な症状を呈しました。この結果から、ネフローゼ発症には、遺伝的背景が大きく影響することが示唆されました。現在、腎疾患増悪・抑制に関与するlocusを探索しております。
本研究室で開発したコンジェニック系統はすべて、バンクより分譲しております。FVB背景系統以外は、Tensin2ホモ欠失で維持可能です。
- Nbio253 B6.ICGN-Tenc1
- Nbio254 D2.ICGN-Tenc1 (ネフローゼ発症)
- Nbio293 FVB.ICGN-Tenc1 (重篤なネフローゼ発症)
- Nbio294 CBy.ICGN-Tenc1
- Nbio295 129.ICGN-Tenc1
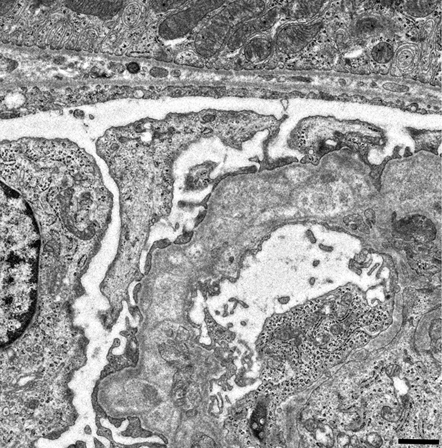
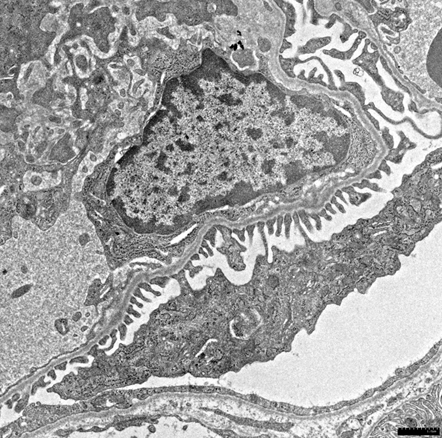
写真の説明
電子顕微鏡での観察像
| D2.ICGN-Tenc1糸球体(4週齢♂) | 正常D2糸球体(4週齢♂) |
|---|---|
 |
 |
組織学的解析
ICGNマウス腎において、病態進行にともなって糸球体および尿細管間質に各種細胞外マトリックス (I型、III型コラーゲン、ファイブロネクチンなど)の蓄積が認められます(Ref.3)。 また、細胞外マトリックスを分解する酵素の活性が低下していることもわかっており、 細胞外マトリックスの産生亢進・分解能低下によって重度の腎線維症が生じます(Ref.4)。
また、線維化の進行には、Transforming Growth Factor-β1が深く関与していること、さらにはシグナル因子であるsmad4が細胞内に増加することが尿細管間質病変を増悪させていることがわかってきました(Ref.5)。
薬物投与腎炎モデルと異なり、糸球体メサンギウム細胞の増殖をともなわない腎線維症モデルであり、多くの研究者が解析に用いております。
腎性貧血モデルとしてのICGNマウス
ICGNマウス腎において、エリスロポエチン産生が低下し、貧血が認められるようになることから、腎性貧血モデルとしても利用可能です(Ref.6)。 ICGNマウスにhEPO(5U/body/day, 5日間)投与により、ヘモグロビン濃度、ヘマトクリット値が正常になることが分かっています(Ref.7)。
参考文献
- Cho A-R, Uchio-Yamada K, Torigai T, Miyamoto T, Miyoshi I, Matsuda J, Kurosawa T, Kon Y, Asano A, Sasaki N, Agui T. Deficiency of the tensin2 gene in the ICGN mouse, an animal model for congenital nephrotic syndrome. Mammalian Genome, 2006 May;17(5):407-416.
- Chen H, Duncan IC, Bozorgchami H, Lo SH. Tensin1 and a previously undocumented family member, tensin2, positively regulate cell migration. Proc Natl Acad Sci U S A. 2002 Jan 22; 99(2):733-738.
- Uchio K, Manabe N, Kinoshita A, Tamura K, Miyamoto M, Ogura A, Yamamoto Y, Miyamoto H, Abnormalities of extracellular matrices and transforming growth factor beta1 localization in the kidney of the hereditary nephrotic mice (ICGN strain). J Vet Med Sci.,1999, 61:769-776.
- Uchio K, Manabe N, Tamura K, Miyamoto M, Yamaguchi M, Ogura A, Yamamoto Y, Miyamoto H., Decreased matrix metalloproteinase activity in the kidneys of hereditary nephrotic mice (ICGN strain). Nephron, 2000, 86:145-151.
- Goto Y, Manabe N, Uchio-Yamada K, Yamaguchi-Yamada M, Inoue N, Yamamoto Y, Ogura A, Nagano N, Miyamoto H., Augmented cytoplasmic Smad4 induces acceleration of TGF-β1 signaling in renal tubulointerstitial cells of hereditary nephrotic ICGN mice with chronic renal fibrosis; possible role for myofibroblastic differentiation. Cell Tissue Res., 2004, 315:209-221.
- Yamaguchi-Yamada M, Manabe N, Uchio-Yamada K, Akashi N, Goto Y, Miyamoto Y, Nagao M, Yamamoto Y, Ogura A, Miyamoto H. Anemia with chronic renal disorder and disrupted metabolism of erythropoietin in ICR-derived glomerulonephritis (ICGN) mice. J Vet Med Sci. 2004, Apr;66(4):423-431.
- Miyamoto Y, Kuramitsu-Miyamoto K, Iwanaga E, Uchio-Yamada K, Yamaguchi-Yamada M, Ogura A, Manabe N. Effect of human erythropoietin (hEPO) treatment on anemia in ICR-derived glomerulonephritis (ICGN) mice. Exp Anim. 2005, 54(2):181-184.
- Uchio-Yamada K, Sawada K, Tamura K, Katayama S, Monobe Y, Yamamoto Y, Ogura A, Manabe N. Tenc1 Deficient Mice Develop Glomerular Disease in a Strain-Specific Manner. Nephron Experimental Nephrology. 2013; 123: 22-33.
- Uchio-Yamada K, Monobe Y, Akagi K, Yamamoto Y, Ogura A, Manabe N Tensin2-deficient mice on FVB/N background develop severe glomerular disease. The Journal of Veterinary Medical Science 78 (5): 811-818, 2016.
ICGNマウス研究会の記録
第3回ICGNマウス研究会のご報告
ヒト遺伝性ネフローゼモデルとして有用なICGNマウスは、 現在医薬基盤・健康・栄養研究所から有償分譲を行っており、 多くの研究者に利用されています。 ICGNマウスはネフローゼモデルとしての特性を備えたモデルマウスですが、 一方で繁殖が困難であること、同週齢・同性別マウスにおいても個体差が大きく、 利用し難いといったデメリットもあります。 ICGNマウスなど腎疾患モデル動物を使用している研究者が交流することにより、 モデルマウスのデメリットを克服し、より有用な系統として確立すること、 さらには腎疾患の病因解明、腎疾患治療への貢献を目指し、 2010年2月26日(金)に医薬基盤・健康・栄養研究所にて第3回ICGNマウス研究会を開催いたしました。 下記の6演題の発表があり、充実した研究会となりました。 今後も年1回研究会を開催させていただく所存でございます。 引き続きご指導、ご鞭撻を賜りますよう、よろしくお願い申し上げます。
第3回ICGNマウス研究会プログラム
- ネフローゼモデルICGNのコンジェニック系統作成と病態解析
- 幼若ICGNマウスの腎病変に対するニバレノールおよびアドリアマイシンの影響について
- ICGNマウスの腎臓におけるcystatin Cの免疫組織学的局在
- NMR-メタボリック・プロファイリングによるマウス新生仔尿の解析
- NMRプロファイリングによるICGNマウス成長時系列尿の解析
- ICGNマウス腎の尿細管間質線維芽細胞においてはSmad-4過多がTGF-β1感受性を高めて筋線維芽化を亢進する
第2回ICGNマウス研究会開催のご報告
ヒト遺伝性ネフローゼモデルとして有用なICGNマウスは、現在医薬基盤 研究所から有償分譲を行っており、多くの研究者に利用されています。 ICGNマ ウスはネフローゼモデルとしての特性を備えたモデルマウスですが、一方で繁殖が困難であること、 同週齢・同性別マウスにおいても個体差が大きく、利用 し難いといったデメリットもあります。 ICGNマウスなど腎疾患モデル動物を使用している研究者が交流することにより、 モデルマウスのデメリットを克服し、より有用な系統として確立すること、 さらには腎疾患の病因解明、腎疾患治療への貢献を目指し、 2008年12月12日(金)に医薬基盤・健康・栄養研究所にて第 2回ICGNマウス研究会を開催いたしました。 ICGNマウスの病態解析だけではなく、NMR-メタボリック・プロファイリングといった新たな解析手法に関する演題もあり、充実した研究会となりました。 今後も年1回研究会を開催させていただく所存でございます。 引き続きご指導、ご鞭撻を賜りますよう、よろしく お願い申し上げます。
第2回ICGNマウス研究会プログラム
- 自然交配・胚移植由来ICGNマウスの病態比較解析
- エリスロポエチン含有ハイドロキシアパタイトを用いた腎性貧血の持続的改善
- ICGNマウスにおける痒み関連行動
- 遺伝性腎疾患モデルマウス(ICGN系マウス)の腎におけるBMP-7を介した TGF-β1の細胞内シグナルの制御異常について
- 実験動物の代謝状態把握と知識発見のためのツール「NMR-メタボリック・プロファイリング」
- 医薬基盤・健康・栄養研究所 高磁場NMR施設の紹介
第1回ICGNマウス研究会開催のご報告
2008年2月15日(金)に医薬基盤・健康・栄養研究所にて第1回ICGNマウス研究会を開催いたしました。
第1回ICGNマウス研究会プログラム
- 遺伝性腎疾患モデルマウス(ICGN系マウス)の腎におけるアクアポーリン発現の異常について
- ICGNマウスの腎臓における組織トランスグルタミナーゼの局在
- ICGNマウスの特性について(①個体差解消法!②維持繁殖のコツ)
ICGNマウス研究会問い合わせ先
医薬基盤・健康・栄養研究所 生物資源研究部
内尾こずえ
TEL:072-641-9852
E-mail: kozue-mt@nibiohn.go.jp
